Kiến Guru trình làng cho tới những em học viên bài xích giải bài xích luyện hoá 10 chương Nguyên tử bài xích 1 và bài xích 2 sách giáo khoa hoá học tập 10. Mong rằng câu nói. giải bài xích luyện hoá 10 sẽ hỗ trợ những em tổng quát lác được nội dung bài học kinh nghiệm và cầm được những dạng bài xích luyện đặc thù.
Bạn đang xem: Giải Bài Tập Hoá 10 Chương Nguyên Tử: Bài 1 Và Bài 2
Bài 1 (trang 9 SGK):
Hạt nhân của đa số những nguyên vẹn tử được cấu trúc kể từ những phân tử là:
A. Electron và proton. B. Proton và nơtron. C. Nơtron và electron. D. Electron, proton và nơtron.
Lời giải:
B: Proton và notron.
Bài 2 (trang 9 SGK):
Các nguyên vẹn tử được cấu trúc đa số vày những hạt:
A. Electron và proton. B. Proton và nơtron. C. Nơtron và electron. D. Electron, proton và nơtron.
Lời giải:
D: Nơtron, proton và electron.
Bài 3 (trang 9 SGK):
Nguyên tử sở hữu 2 lần bán kính vội vàng khoảng chừng 10.000 đợt 2 lần bán kính phân tử nhân. Phóng đại phân tử nhân lên trở thành một trái khoáy bóng sở hữu D=6cm thì 2 lần bán kính nguyên vẹn tử tiếp tục là:
A. 200m. B. 300m. C. 600m. D. 1200m.
Lời giải: C
Đường kính phân tử nhân Lúc phóng to: 6cm.
Đường kính nguyên vẹn tử: 6cm × 10.000 = 60.000cm = 600m.
Bài 4 (trang 9 SGK):
Tìm tỉ số về lượng m của electron với proton, với nơtron.
Lời giải:
Tỉ số về lượng m của electron với proton:
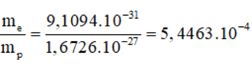
Tỉ số về lượng m của electron với nơtron:
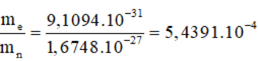
Bài 5 (trang 9 SGK):
Nguyên tử kẽm sở hữu nửa đường kính r = 1,35.10-1 nm, lượng nguyên vẹn tử là 65u.
a) Nguyên tử Zn sở hữu lượng riêng rẽ bao nhiêu? b) Trên thực tiễn, đa số toàn cỗ lượng nguyên vẹn tử triệu tập ở phân tử nhân với r = 2.10-6 Tính lượng riêng rẽ D của phân tử nhân nguyên vẹn tử Zn.
Cho biết Vhình cầu = 4/3 π.r3.
Lời giải:
a) rZn = 1,35. 10-1 nm = 0,135.10-7 centimet (1nm = 10-9m)
1u = 1,6600.10-24 g.
mZn = 65.1,6600.10-24 g = 107,9.10-24g.
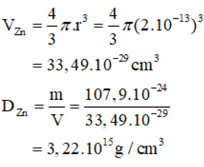
b) mhạt nhân Zn = 65u ⇒ 107,9.10-24 gam
rhạt nhân Zn = 2.10-6 nm = (2.10-6.10-7) centimet = 2.10-13 centimet.
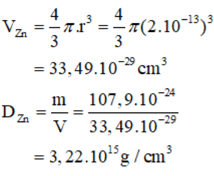
II. Giải bài xích luyện hoá 10 Bài 2 - Hạt nhân nguyên vẹn tử - Nguyên tố chất hóa học - Đồng vị
Bài 1 (trang 13 SGK):
Nguyên tố chất hóa học bao gồm những nguyên vẹn tử cùng:
A. Số khối. B. Số notron. C. Số proton. D. Số notron và số proton.
Lời giải: C.
Bài 2 (trang 13 SGK):
Kí hiệu nguyên vẹn tử biểu thị tương đối đầy đủ những đặc thù cho 1 nguyên vẹn tử của một thành phần chất hóa học vì như thế nó mang lại biết:
A. Số khối. B. Số hiệu nguyên vẹn tử Z. C. Nguyên tử khối của nguyên vẹn tử. D. Số hiệu nguyên vẹn tử Z, số khối A.
Lời giải: D.
Bài 3 (trang 14 SGK):
Nguyên tố cacbon sở hữu nhị đồng vị: 12C cướp 98,89% và 13C Nguyên tử khối tầm của cacbon là:
A. 12,500. B. 12,011. C. 12,022. D. 12,055.
Lời giải:
Đáp số thực sự B
Atb= (12.98,89+13.1,11)/100=12,011
Bài 4 (trang 14 SGK):
Xác quyết định những thông số kỹ thuật sau: năng lượng điện phân tử nhân, số proton, số nơtron, số electron, nguyên vẹn tử khối của những nguyên vẹn tử với mọi nguyên vẹn tố: 7Li, 19F, 24Mg, 40Ca
Lời giải:
Bài 5 (trang 14 SGK):
Đồng sở hữu nhị đồng vị bền 63Cu và 65C. Đồng sở hữu nguyên vẹn tử khối tầm là 63,54. Tính bộ phận Phần Trăm số nguyên vẹn tử của từng đồng vị
Lời giải:
Gọi x là bộ phận % của đồng vị 65C
Ta có:
Ta có: (65x+63(100-x))/100=63,54 →x=27% → %63Cu =73%
Bài 6 (trang 14 SGK):
Hidro sở hữu nguyên vẹn tử khối là 1 trong những,008. Hỏi sở hữu từng nào nguyên vẹn tử của đồng vị 2H vô 1ml nước (cho rằng nội địa chỉ mất đồng vị 1H và 2H )? (Cho lượng riêng rẽ của nước là 1g/ml)
Lời giải:
Gọi % đồng vị 2H là a:
m của 1ml H2O: 1 gam
⇒MH2O = 2. 1,008 + 16 = 18,016u
Khối lượng của một mol H2O là 18,016g.
Khối lượng của một mol H2O là 18,016g.
Số mol H2O = 1/18,016 mol
⇒ số mol nguyên vẹn tử H = 2.nH2O = 2/18,016 mol
1 mol nguyên vẹn tử chứa chấp 6,022.1023 nguyên vẹn tử
⇒ Số nguyên vẹn tử H vô 1ml H2O = 2/18,016.6,022.1023
⇒ Số nguyên vẹn tử 2H vô 1ml H2O = 0,8%.2/18,016.6,022.1023
=5,35.1020 (nguyên tử)
Bài 7 (trang 14 SGK):
Oxi đương nhiên là 1 trong lếu láo thích hợp những đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên vẹn tử của từng loại đồng vị Lúc có một nguyên vẹn tử 17O
Lời giải:
Khi có một nguyên vẹn tử 17O, nhưng mà % nguyên vẹn tử của17O = 0,039%
⇒ Số nguyên vẹn tử O = 1 : 0,039% = 2564 nguyên vẹn tử
99,757% 16O ⇒ Số nguyên vẹn tử 16O = 99,757%.2564 = 2558 nguyên vẹn tử
0,204% 18O ⇒ Số nguyên vẹn tử 18O = 0,204%.2564 = 5 nguyên vẹn tử
Bài 8 (trang 14 SGK):
Agon tách rời khỏi kể từ bầu không khí là lếu láo thích hợp phụ thân đồng vị: 99,6% 40Ar; 0,063% 38Ar; 0,337% 36Ar. Tính thể tích của 10g Ar ở ĐK chi phí chuẩn
Lời giải:
MAr=(40.99,6+0,063.38+0,337.36)/100=39,985
Xem thêm: Kích thước ảnh bìa Facebook-Meta 2023 chuẩn nhất
nAr=m/M=10/39,985 mol
VAr=22,4.n=5,602 lit
Kiến Guru ngóng rằng câu nói. giải bài xích luyện hoá 10 chương Nguyên tử bài xích 1: Thành phần nguyên vẹn tử và bài xích 2: Hạt nhân nguyên vẹn tử - Nguyên tố chất hóa học - Đồng vị sẽ hỗ trợ những em cầm vứng kỹ năng chương Nguyên tử và học tập chất lượng tốt môn Hoá học tập 10.